Histoire et Chimie des savons 1/2. Savons-nous tout sur les savons ?

Les savons sont utilisés pour de nombreux usages : lavage corporel, du linge, d’ustensiles, de vaisselle etc. L’effet recherché est souvent le même : dégraisser, décaper. Mais l’efficacité et les propriétés secondaires diffèrent, d’où une utilisation de savons différents pour différents usages.
Date de publication : 05/04/20
Le savon une histoire ancienne1–5
Minéraux
Les premiers savons étaient minéraux. Les égyptiens utilisaient du natron pour se laver, et un mélange de natron et de stéatite (talc) pour dégraisser leurs vêtements. Le natron se récolte après évaporation de lacs ayant une teneur importante en sels minéraux tels que le bicarbonate et le carbonate de sodium. Les sels sont composés d’ions, c’est-à-dire d’atomes qui ont gagné ou perdu un ou plusieurs électrons. Chaque ion est chargé positivement ou négativement, mais l’assemblage en sel est neutre. Concrètement, le natron contient 2 ions de sodium (Na+) pour un ion de carbonate (CO32-). La structure de ce sel est assez poreuse pour contenir de l’eau, d’où sa formule : Na2CO3·10H2O. L’alun (KAl(SO4)2·12 H2O) était un autre sel utilisé pour laver les habits chez les babyloniens. Remarquez que l’alun contient du potassium (K) et de l’aluminium (Al).
La propriété de ces minéraux lavant est l’alcalinité. Alcalin ou basique, c’est l’inverse d’acide, et nous verrons plus tard en quoi le fait d’être alcalin permet de laver. La potasse (KOH) et la soude (NaOH), d’autres substances alcalines, étaient extraites de lacs tel que le lac de Van en Turquie et servaient aussi au lavage.
Végétaux
Les substances alcalines lavantes peuvent aussi provenir de plantes. Elles servaient au lavage du corps, de la maison et des habits et étaient extraites de plantes et de bois après calcination. Pour cela, les babyloniens brulaient lentement des végétaux préalablement séchés, puis lavaient les cendres pour récupérer une eau visqueuse chargée en substances alcalines : de la potasse et de la soude essentiellement. Enfin, ils faisaient évaporer cette eau de lavage pour ne récupérer que les cristaux de ces substances. Les végétaux calcinés par les babyloniens étaient des plantes grasses (Mesembrianthemum copticum, Salsola soda), alors qu’en Inde et à Palmyre on utilisait de la salicorne. La salicorne est aussi une plante grasse, elle pousse sur des sols riches en minéraux et sels. Il est possible de faire de « l’eau de cendre » pour laver sont linge, un liquide visqueux chargé de soude et de potasse, en mélangeant de l’eau avec de la cendre de bois puis en filtrant ce mélange.

Salicorne (source)
Les plantes n’étaient pas forcément calcinées pour en faire des agents nettoyants: certaines plantes telle que la saponaire (Saponaria officinalis) furent directement utilisées comme savons. Nous reviendrons sur ces savons « naturels » plus tard.
Minéraux et plantes
Au cours de l’histoire de l’humanité vint ensuite la fabrication des savons à proprement parlé. Les Papyrus d’Eber (-1350) renferment une recette à propos d’un mélange d’huile et de plâtre à faire bouillir. Le mélange de matières grasses, de sels et de plantes alcalines se généralise. C’est la saponification. L’huile de ricin (Ricinus communis), aussi connu sous le nom de « castor oil » dans la nomenclature internationale, est commune en Mésopotamie. Elle a la particularité de donner un savon très moussant et décapant, et se saponifie sans chauffage excessif. Des tablettes Sumériennes proposent quant à elles un mélange d’huile de cannelle et de salicorne comme base de savon.
Le savon tel que nous le connaissons est effectivement issu d’un mélange de matières grasses avec une substance alcaline (soude, potasse, extraits de certaines plantes). L’huile d’olive comme matière grasse et la chaux vive comme substance alcaline étaient utilisées en Algérie pour faire les premiers savons, alors que de la graisse de bœuf et un mélange de cendre et de chaux étaient utilisés en Gaule. Cependant le savon n’était pas forcément généralisé au début de notre ère. Dans les pays du Nord, les bains de vapeurs accompagnés de battages avec des branches de hêtre ou de chêne sont les techniques utilisées pour laver les corps. Les Romains utilisaient les bains publics avec des bassins à température différentes et ceci sans savons ou produits similaires. Aux époques Romaine et post-Romaine, l’urine qui pouvait aussi être utilisée pour nettoyer le linge !

Substances ou mélanges de substances lavantes
Ce n’est qu’au moyen âge que l’utilisation de savon fut remise au goût du jour, au XIIIème siècle Marseille rimait avec savon et avec elle d’autres villes méditerranéennes : Gêne, Venise. Le savon de Marseille était fait de substances alcalines, bien sûr, mais aussi d’huile d’olive. Les graisses animales étaient utilisées plus généralement au centre de l’Europe et l’huile de poisson dans les pays du Nord européen. Le savon à base d’huile d’olive était utilisé pour le bain alors que les autres étaient destinés au lavage du linge.
Au cours du XXème siècle les savons et agents lavant vont connaitre une avancé spectaculaire. Mais avant de poursuivre dans cet historique des savons, et de comprendre un peu mieux l’origine des agents détergents modernes, il convient de comprendre ce qu’est un savon. Ceci nous permetra de comprendre enfin pourquoi on mélange des substances grasses et et alcalines pour faire les savons.
Pourquoi le savon savonne ?5
Un savon, un agent de surface, un tensioactif ou encore surfactant peuvent être assimilés à des détergents, c’est-à-dire à des agents lavant. Nous emploierons indistinctement ces termes dans la suite de l’article afin d’éviter les répétitions, même si nous préférerons le terme de tensioactif. Les tensioactifs sont d’origines diverses (végétale, animale, pétrochimique) avec des structures qui peuvent être très différentes, mais leur propriété générale et leur mode de fonctionnement sont très similaires : ils lavent grâce à leurs propriétés physico-chimiques.
Les agents tensioactifs sont généralement composés de deux parties : une qui aime l’eau, l’autre qui aime la graisse. On peut les assimiler à une gomme qui est partagée en deux entre le côté orange et le côté bleu. Cette propriété est très importante.

Un surfactant est composé d’une partie aimant l’eau et d’une autre aimant la graisse
Pour nettoyer, les molécules de savons jouent leur rôle en 3 étapes :
- Les molécules de savon (les agents tensioactifs) sont dans l’eau, et voilà à l‘horizon une tache de graisse sur un t-shirt. La partie de la molécule qui affectionne la graisse va littéralement s’incruster dans la tâche. La partie de la molécule qui préfère l’eau reste en-dehors de la tâche.
- Mais la tache ne se décrochera pas si facilement à cause de la tension superficielle qui existe entre elle et l’eau. Cette force permet aux molécules de graisse de se regrouper pour avoir le moins de surface de contact avec les molécules d’eau : l’eau et la graisse ne s’aiment pas. Cette tension superficielle peut être mise en évidence quand on pose un trombone à la surface l’eau et qu’il flotte par exemple. Mais revenons à la tache. A cause de cette force, les molécules grasses qui composent la tache restent regroupées et sa dispersion est impossible. Interviennent alors les propriétés des savons qui en incrustant leur partie qui aime la graisse au sein des taches ont pour effet de casser l’énergie qui maintient la tache en forme. D’ailleurs si on pose un trombone à la surface de l’eau et qu’on y ajoute un tensioactif, le trombone coule. Preuve que le tensioactif casse les forces à la surface de la tâche, il casse la force de tension superficielle. Une fois les particules de savon avec une partie au sein de la tache et une autre à l’extérieur, elles vont entraîner la création de bulle de taches : la micelle. Vous comprennez alors pourquoi les agents lavant, les savons, sont appelés : agents tensioactifs.
- Une fois la tache détachée et sous forme des bulles avec le savon à la fois dans la tache et à l’extérieur (micelles), cette dernière est entrainée avec l’eau de lavage.
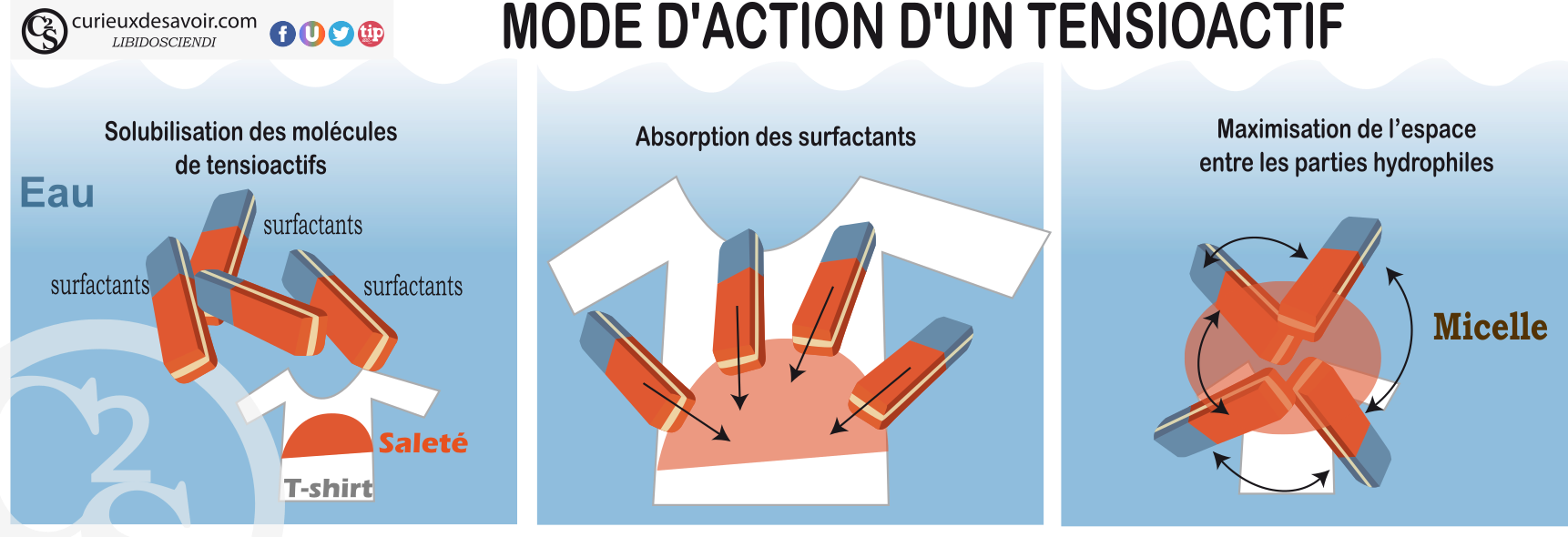
Les différentes phases d’action du savon
L’essentiel à retenir est qu’un détergent est composé de deux parties : une qui aime l’eau et une autre qui aime la graisse. Il permet de « casser » la graisse et de la mettre sous forme de petites billes qui sont facilement emportées par l’eau de lavage.
La structure générale des savons
Les savons fabriqués
Le savon tel que le savon de Marseille ou encore les détergents fabriqués par nos ancêtres étaient des mélanges de matière grasse (huile d’olive, huile de ricin, gras de porc) et de matières alcalines (chaux, cendres, plâtre). Ce mélange produit la transformation chimique suivante :

La réaction de saponification sur une matière grasse (triglycéride) donne trois molécules de savon et de la glycérine.
Dans certains cas, comme nous l’avons vu au début, nos ancêtres utilisaient directement des produits caustiques pour laver (natron, cendre etc.). Ces produits réagissent tout simplement avec la graisse présente sur le linge ou les surfaces. Ainsi, du « savon » est créé directement à partir de la saleté, et va lui-même « travailler » à enlever les autres taches de graisse. C’est le principe de l’eau de cendre qu’on peut utiliser en machine. Quant à l’urine utilisée dans l’antiquité, c’est le carbonate d’ammonium qu’elle contient qui réagit avec les matières grasses.
Les savons « naturels »
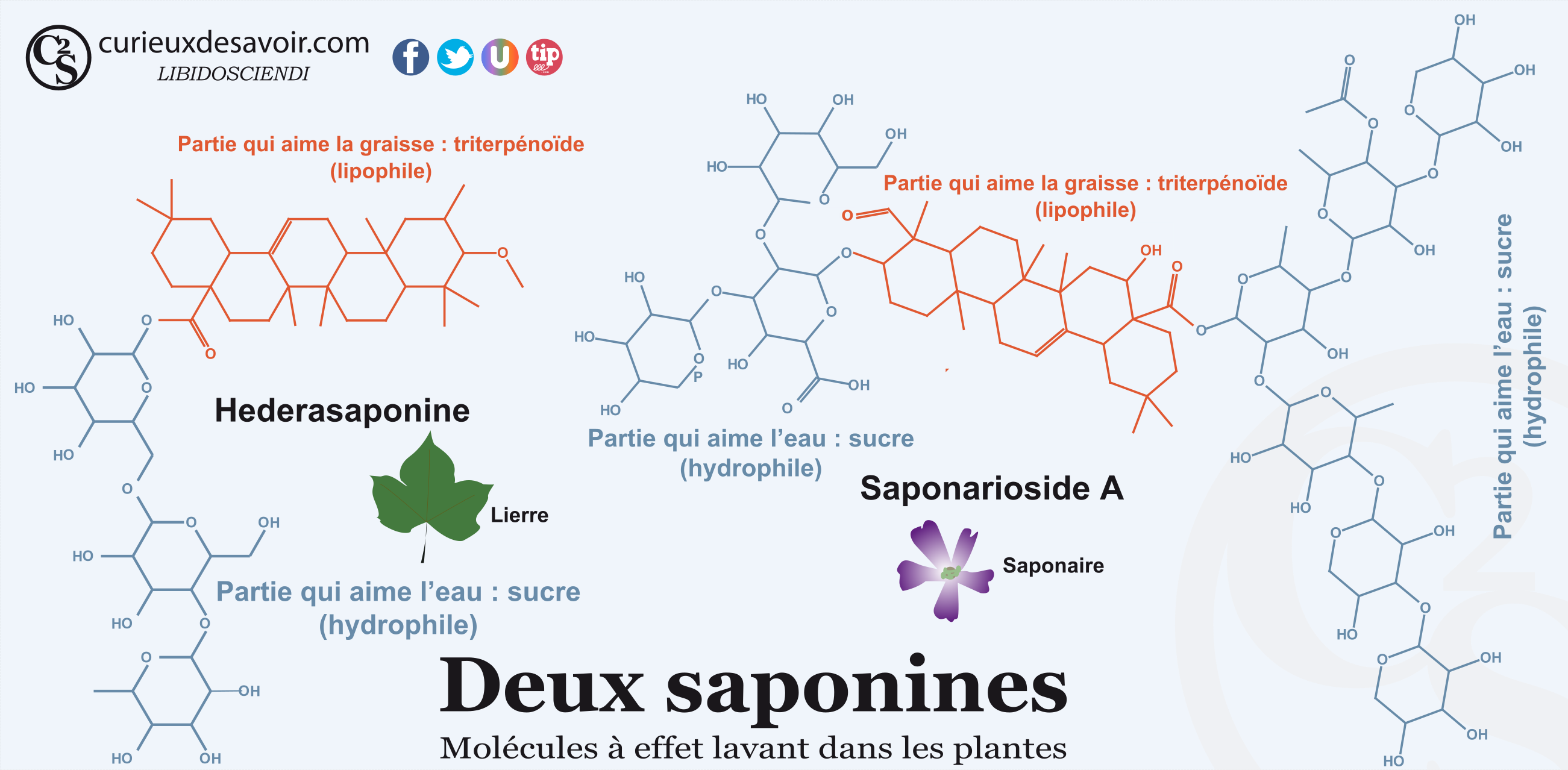
Certaines plantes peuvent contenir des savons « naturels » : les saponines. Ces saponines sont nombreuses et ont une structure très complexe. Elles sont composées de sucres, pour la partie hydrophile (celle qui aime l’eau), reliés à des triterpenoides, des stéroïdes ou des alcaloïdes, pour la partie lipophile (celle qui aime la graisse). Comme nous le verrons un petit peu plus loin, des tensioactifs modernes ont été inspirés de ces saponines en étant fabriqué à base d’amidon ou de résidus de sucre. Les saponines triterpénoïdes sont très présentes dans le milieu végétal et notamment dans les aliments comme les haricots, les épinards, les tomates, les pommes de terre6 ou le quinoa7. Les saponines ont un effet de pesticide dans les plantes en agissant directement sur les insectes8 ainsi qu’en rendant l’aliment amer. C’est pour cela qu’il faut rincer le quinoa avant de le manger ! Les Incas mettaient des sacs de quinoa dans les rivières pour laver les grains ainsi que pour tuer les poissons !9 On peut aussi citer le saponarioside A contenu dans la fleur de saponaire (Saponaria officinalis)10 ou l’hederasaponine dans le lierre11,12. De la lessive de lierre peut ainsi être préparée tout simplement en infusant du lierre (voir la partie expérience). Les fruits de l’arbre Sapindus sont également utilisés pour la lessive13 : les désormais célèbres noix de lavage.
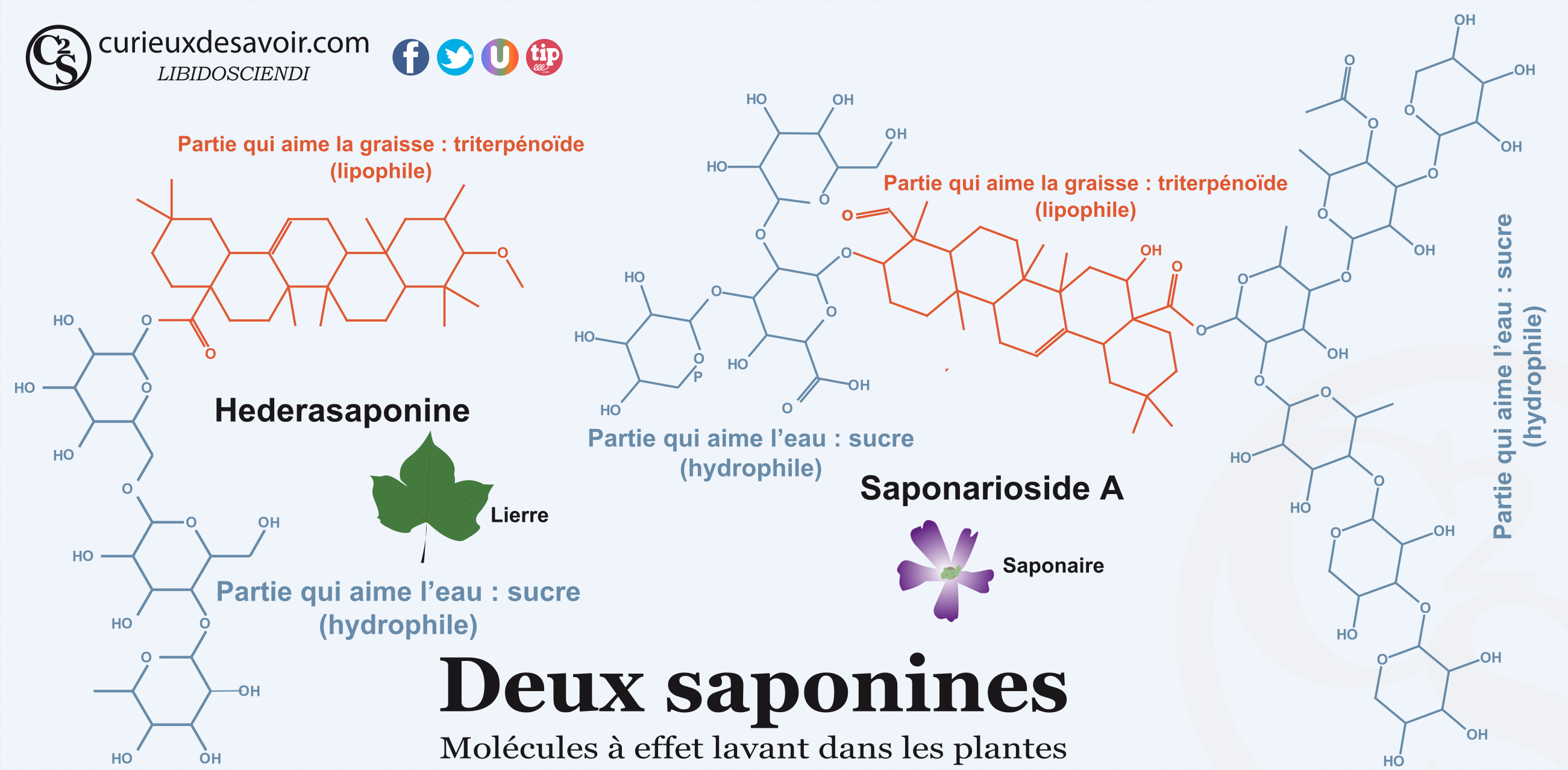
Exemple de deux saponines, celle du lierre et celle de la saponaire. C’est tellement beau !
Vers les nouveaux savons
L’avènement de la chimie conduira à une amélioration sans précédent des savons. La réaction entre des huiles et l’acide sulfurique, qui donne un savon dit « sulfaté », fut remarquée dans les années 1830. Ce type de savon a pour effet de ne pas interagir aussi fortement que les savons classiques avec le calcium et le magnésium de l’eau et sera utilisé dans l’industrie textile14. En effet, les savons ont la fâcheuse tendance à réagir avec ce que l’on appelle la dureté de l’eau, (le claclaire, soit du calcium et du magnésium), ce qui les empêche de faire leur boulot initial : laver.
La première poudre de détergent sulfatée est utilisée comme lessive en 1932. Fabriquée à base d’huile de coco, c’est la première large utilisation du lauryl sulfate de sodium. Lors de la première guerre mondiale les Allemands sont à court d’huiles végétales et ils ont alors l’idée d’utiliser comme matière première du naphtalène, un résidu du pétrole. Ils inventent les premiers savons synthétiques : les naphtalènes sulfonates alkylés. Après la seconde guerre mondiale, les détergents à base de pétrole sont deux fois moins chers que ceux à base de matières grasses renouvelables14. On a là inventé non seulement des savons dont la matière première coule alors à flot, mais aussi de nouveaux types de savons ! Une explosion de nouveaux savons voit le jour avec le début de la chimie moderne et de l’utilisation de dérivés du pétrole. Les chimistes vont ainsi « jouer » sur les parties lipophiles et hydrophiles des savons pour fabriquer des détergents aux propriétés multiples15.
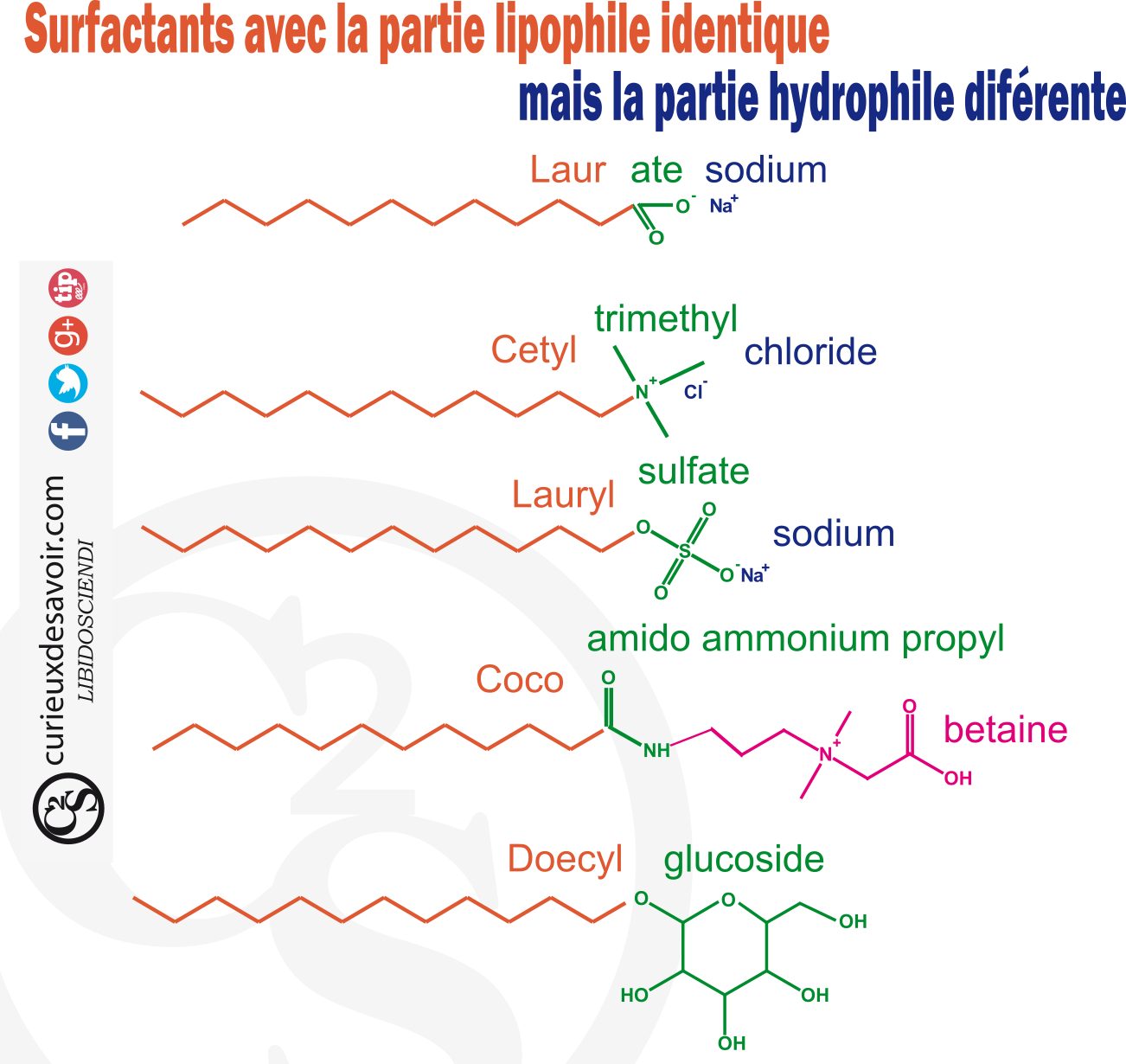
Savons à la partie lipophile identique mais à la partie hydrophile différente
La longueur et la composition de la partie lipophile influence la capacité du tensioactif à se solubiliser dans les graisses à laver mais aussi à former des micelles. La partie hydrophile influence la solubilisation dans l’eau mais aussi sur la capacité du savon à réagir avec d’autres composés comme le calcium ou le magnésium. Rappelez-vous : le problème de ces ions rendent l’eau « calcaire » et réagissent avec les savons, les rendant ces derniers moins performants. Tout l’art des lessives, savons et poudres de lavage est de mélanger des tensionactifs complémentaires.
Conclusion
- Pour nettoyer, nos ancêtres ont utilisé des minéraux et des plantes. Puis ils ont synthétisé des savons en mélangeant des matières grasses avec des composés caustiques.
- Les savons sont composés de deux parties : une qui aime la graisse, l’autre l’eau.
- De nouveaux savons à base de pétrole sont fabriqués, ceci permet de modeler leurs propriétés.
- D’après nos expériences (vidéos), la lessive de lierre comme produit vaisselle est intéressante.
Bonus
Mes recettes de produits cosmétiques, dont les savons : sur mon blog
Remerciements
Merci à Clément Heinrich (Docteur en pharmacie) et à Christophe Oliver (Enseignant et EEMCP2 en SPC au lycée Rochambeau) pour leurs aide et/ou relectures.
Phosphoré par : Gontier Adrien, Jaeger Catherine
Mots clefs : Savon, Lessive, Surfactant